
帕金森病(PD)是一种常见的中老年神经系统退行性疾病。流行病学调查研究显示,我国 65 岁以上人群帕金森病患病率为 1.7%,未来预计我国 PD 患者人数将从 2005 年的 199 万人上升至 2030 年的 500 万人,几乎占到全球 PD 患者的一半[1]。
一
运动并发症:
中晚期帕金森病患者的灾难
随着疾病的进展和长期接受左旋多巴治疗,患者会产生运动并发症,包括症状波动和异动症[1]。运动并发症可发生在服用左旋多巴几个月后,平均发病时间估计为 6.5 年[2]。一项中国患者的横断面研究显示,左旋多巴治疗 5~10 年后,运动并发症发生率达 57~90%[3]。
有的患者会感觉药没有以前管用,吃药后很久才起作用,并且作用持续时间较以前短。这可能是患者发生了「剂末现象」或「开关现象」,这也是最典型的症状波动。
台湾中山大学李良修教授,36 岁就得了帕金森病,他在《走过帕金森幽谷》一书中,这样描绘帕金森病的「开关现象」:
「生命,对许多人来说,是出生与死亡两个端点中间的一条线,上帝的钥匙只开关一次;对帕金森病患者来说,生命是每天好几次生死的搏斗,每天『开关』好几回,『一开一关』犹如从天堂坠入地狱。」
「从天堂坠入地狱」,是对「开关现象」给患者带来极端痛苦最确切的描述。
运动并发症的出现使患者的生活质量恶化,医疗支出增加,甚至加剧功能残疾;症状波动和异动症所造成的残疾有时比 PD 本身的运动障碍更为严重。运动并发症管理已成为 PD 患者需要被关注及解决的关键性问题[4]。
二
运动并发症的管理,
中国新版治疗指南怎么说?
1. 早期帕金森病患者,预防运动并发症
2020 年中国帕金森病治疗指南(第四版)指出,帕金森病治疗不仅立足当前,而且需长期管理,以达到长期获益[1]。因此,早期 PD 的治疗必须考虑初始治疗的长期效果,选择一种能降低或至少推迟最终发生运动并发症风险的方案[4]。第四版指南强调提供持续性多巴胺能刺激(CDS)的药物或手段可以对运动并发症起到延缓和治疗作用[1]。
CDS 以优化多巴胺能的药物代谢动力学为核心,通过作用时间长的多巴胺能药物或者改进多巴胺能药物的给药模式,从理论上提供更加持续的多巴胺能刺激[5]。这种持续性的,即非间歇性或非脉冲式的刺激多巴胺受体可推迟或预防左旋多巴相关运动并发症的发生[6]。基于这一理念,长效的多巴胺受体激动剂(DAs)受到了广泛关注。一项 Meta 分析表明,DAs 单药起始治疗较左旋多巴单药起始治疗显著降低异动症风险 87%,即便在随后的治疗中添加左旋多巴,异动症风险仍显著低于左旋多巴单药起始组[7]。
第四版指南也指出:主要推崇采用非麦角类 DAs,并作为早发型患者病程初期的首选药物[1]。
2. 中晚期帕金森病患者,改善症状波动和异动症
第四版指南中,对于症状波动和异动症的处理,专家均推荐 PD 患者加用产生 CDS 的长半衰期 DAs(图 1,图 2)[1]。

图 1. 帕金森病患者症状波动的处理原则
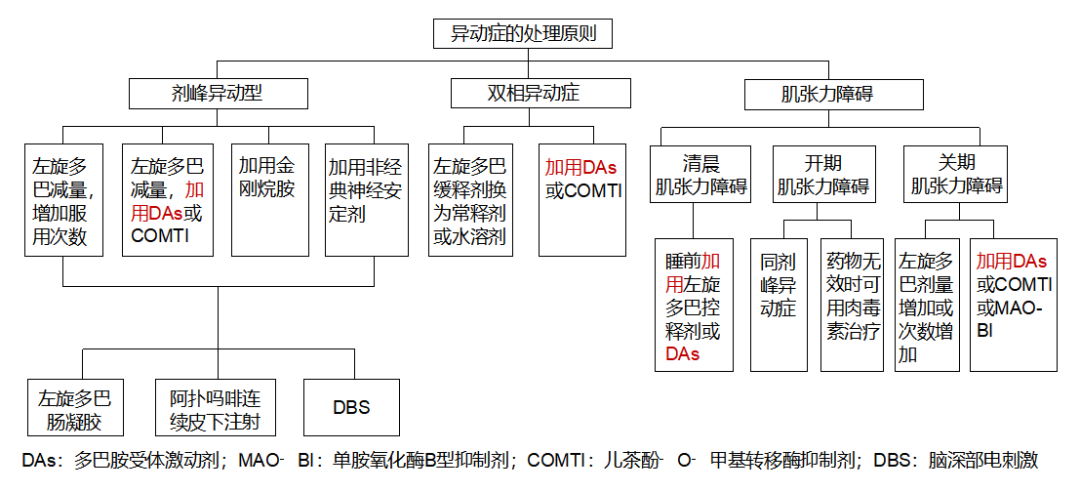
图 2. 帕金森病患者异动症的处理原则
三
普拉克索优化帕金森病患者的
运动并发症管理,两种剂型,更多选择
普拉克索作为一种非麦角类 DA,高选择性地作用于多巴胺 D2 受体亚家族,对 D3 受体的亲和力最高,半衰期长达 8~12 h[8],可以提供持续的多巴胺能刺激,且对 D1 受体无亲和力,不会诱发运动并发症。基于多项 ClassⅠ 证据,国际指南对普拉克索控制运动症状和预防运动并发症的疗效均给予「有效」/「A 级」推荐[9,10]。普拉克索缓释片(SR)是在速释片(IR)的基础上研发出来的一种新剂型[11]。普拉克索缓释片和速释片仅在释放药物的方式上有所不同。药物本身并没有本质改变,即它们有相同的受体靶点、等同的疗效和等同的受体结合力[12]。与速释片(IR)相比,普拉克索缓释片(SR)血药浓度更平稳,峰谷波动更小,可以提供 24 小时的更持续性的多巴胺能刺激[13]。速释片可由当前日剂量直接等剂量隔夜转换成缓释片[14]。
1. 预防运动并发症
CALM-PD 是一项随机对照双盲的多中心临床研究,探索早期 PD 患者接受起始普拉克索治疗,对比起始左旋多巴治疗的多巴胺能运动并发症的发生风险。随访 2 年结果显示,普拉克索起始治疗较左旋多巴起始治疗显著降低剂末现象风险 43%(危险比[HR] = 0.57, 95% 置信区间[CI] 0.37~0.88, P = 0.01),显著降低异动症风险 67%(HR = 0.33, 95% CI 0.18~0.60, P < 0.001),总体运动并发症风险减少 55%(HR = 0.45, 95% CI 0.30~0.66, P < 0.001)[15]。
随访至 6 年,即使普拉克索组 90% 的患者已加用左旋多巴,但普拉克索起始治疗组的运动并发症仍显著低于左旋多巴起始治疗组(50.0% vs 68.4%),且具统计学意义(P = 0.002)(图 3)[16]。
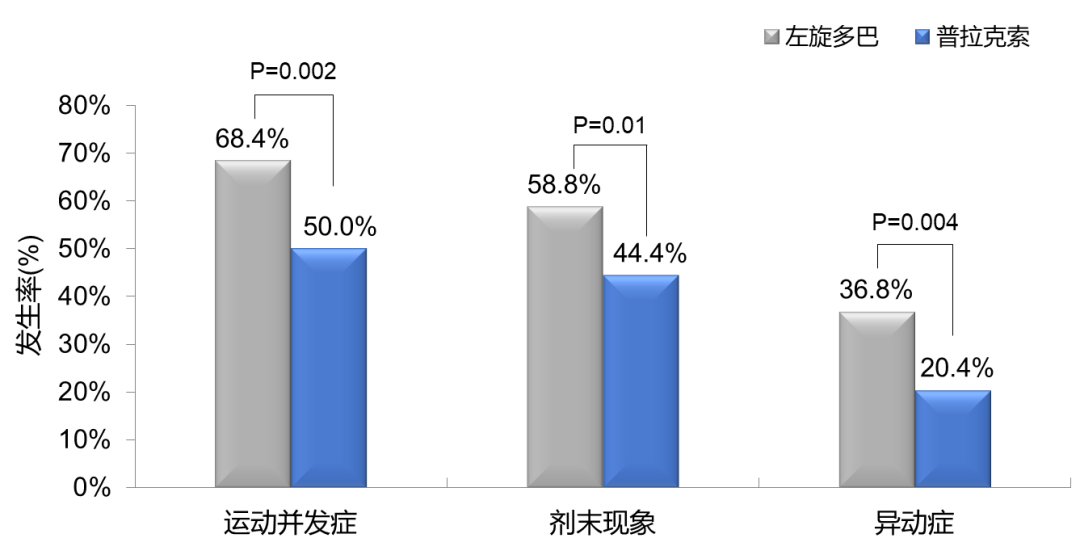
图 3. 普拉克索 vs 左旋多巴治疗早期 PD 患者的运动并发症发生率(CALM-PD 6 年随访)
2. 治疗症状波动,减少关期时间
一项纳入 44 项随机研究的 Meta 分析(N = 8436),评估 DAs、儿茶酚-O-甲基转移酶(COMT)抑制剂和单胺氧化酶 B(MAO-B)抑制剂,作为已经发生运动并发症患者的左旋多巴添加治疗,一类药物是否比另一类药物能更好地控制症状。结果发现,晚期PD患者联合 DAs 显著改善症状波动,减少关期时间(DAs -1.53 h/天 vs COMTI -0.83 h/天 vs MAO-BI -0.93 h/天, P = 0.0003),DAs 中普拉克索减少关期时间最高,为 1.81 h/天(图 4)[17]。

图 4. 普拉克索 vs 其他药物治疗的关期时间变化
另一项多中心、随机、双盲、平行组研究,纳入经左旋多巴治疗出现症状波动后,接受普拉克索速释片和缓释片治疗的患者(N = 507),评估了普拉克索改善关期的疗效。治疗 18 周的结果表明,普拉克索显著改善症状波动,关期时间较基线(5~6 小时/天)减少 2.1~2.5 小时/天(SR 2.1 h, IR 2.5 h vs 安慰剂 1.4 h),差异具有统计学意义(与安慰剂比较的 P 值分别为 P = 0.0199, P < 0.0001)[18]。
3. 包含中国数据在内的多项研究:普拉克索缓释片与速释片同样有效
已有多项研究证实,普拉克索速释片和缓释片在 PD 患者中表现出相似的疗效、安全性和耐受性[19,20]。
普拉克索缓释片的中国 III 期临床研究(一项双盲、随机、平行组研究,N = 473)证实,普拉克索缓释片和速释片均显著改善 UPDRS II + III 评分(-13.81 vs -13.05)、改善关期(-1 h vs -1.1 h)、增加开期(1 h vs 1 h)均非劣于速释片(95% CI = −1.047, 2.566;-1.047 > −4[非劣效性边界])[21]。
4. 缓释片与速释片总体安全性相当,但患者依从性更佳,为医生和患者提供更多选择
安全性方面,两种剂型的总体安全性相当,常见不良反应(如胃肠道等)发生率相似[19~23]。普拉克索缓释片能显著减少多种冲动控制障碍(ICDs)并存的状况,且与罗匹尼罗缓释片相比,普拉克索缓释片 ICD 风险更低(图 5)[23]。另一项回顾性研究评估了 DAs 缓释片上市前后对 PD 患者的影响,结果显示,DAs 的缓释制剂可以显著减少导致 DAs 减量或撤药的不良反应(12.3% vs 18.9%,P < 0.01),优化治疗[24]。
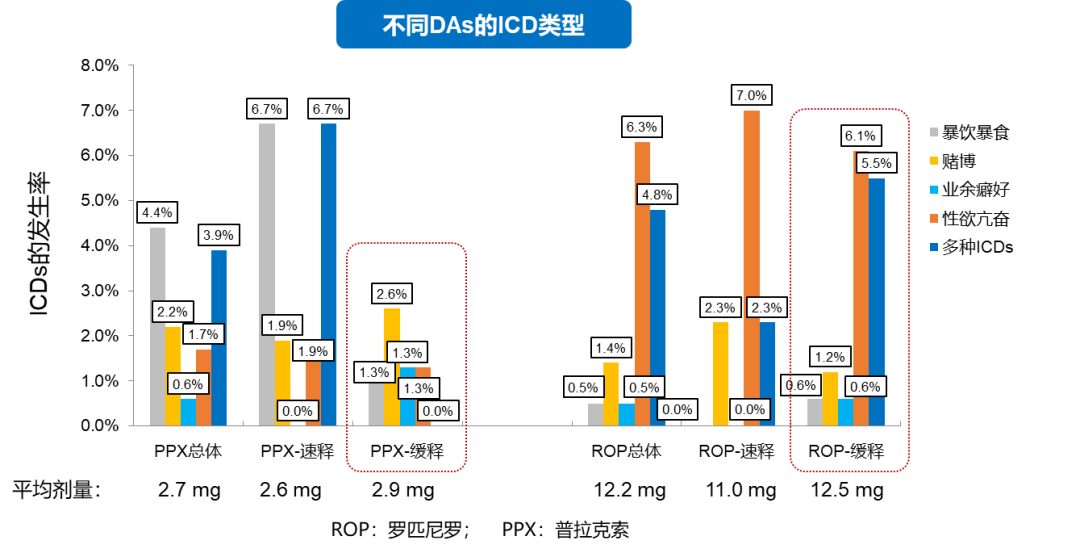
图 5. 不同多巴胺受体激动剂的 ICDs 类型
一项开放标签的延长期研究中,调查了早期和晚期 PD 患者对普拉克索一天一次(QD)和一天三次(TID)的偏好程度,结果显示,早期或晚期 PD 患者对 QD 有强烈的偏好(图 6)。且这种偏好的晚期 PD 患者比例高达 88.9%,与是否有合并用药无关[25]。
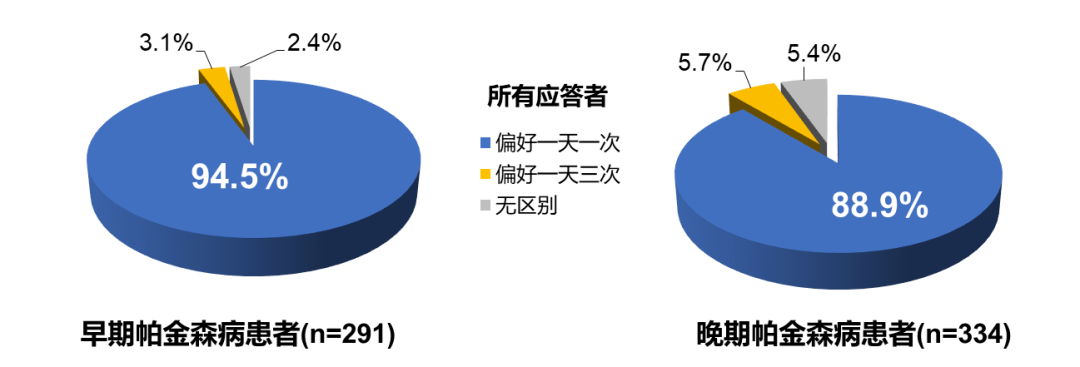
图 6. 早期和晚期 PD 患者的用药偏好
2020 年发表的一项台湾回顾性横断面研究,评估了普拉克索缓释片上市前后的临床使用情况。结果显示,普拉克索缓释片上市后医生处方观念改变,普拉克索缓释片的患者剂量更高,缓释片的服药依从性高于速释片(以药物占有率计算,73% vs. 65%)。缓释片的这些优势可能会转化为更好的患者预后[26]。
总结
疾病进展和长期左旋多巴治疗导致的运动并发症,严重危害 PD 患者的生活质量。对于运动并发症的管理不仅要立足当前,更要注重长期管理。CDS 理念是新版指南运动并发症管理的关键策略。普拉克索作为符合 CDS 治疗理念的长效多巴胺受体激动剂,在预防运动并发症和治疗症状波动方面均获国际指南 A 级推荐;而近年来广受好评的普拉克索缓释片,通过持续性多巴胺能给药,是 CDS 理念的实际应用,疗效和总体安全性都与速释片相当,但是缓释片一天一次的服用方式更简便,可以提供 24 小时更持续的多巴胺能刺激,患者血药浓度更平稳,依从性更高,为帕金森病患者运动并发症的优化管理提供了更多治疗选择。
内容审核:王茉、马森
题图来源:站酷海洛
头图来源:自行设计
参考文献:
[1]. 中华医学会神经病学分会帕金森病及运动障碍学组. 中国帕金森病治疗指南(第四版). 中华神经科杂志. 2020,53(12): 973-986.
[2]. Tran TN, Vo TNN, Frei K, et al. Levodopa-induced dyskinesia: clinical features, incidence, and risk factors. J Neural Transm (Vienna). 2018;125(8):1109-1117.
[3]. Kum WF, Gao J, Durairajan SS, et al. Risk factors in development of motor complications in Chinese patients with idiopathic Parkinson's disease. J Clin Neurosci. 2009;16(8):1034-1037.
[4]. 陈生弟. 帕金森病运动并发症的防治策略. 中华老年医学杂志, 2016, 35(004):343-346.
[5]. 冯涛, 王拥军. 持续性多巴胺能刺激治疗帕金森病的研究进展. 临床神经病学杂志, 2008, 21(4):315-317.
[6]. Stocchi F. The therapeutic concept of continuous dopaminergic stimulation (CDS) in the treatment of Parkinson's disease. Parkinsonism Relat Disord. 2009 Dec;15 Suppl 3:S68-71.
[7]. Chondrogiorgi M, Tatsioni A, Reichmann H, et al. Dopamine agonist monotherapy in Parkinson's disease and potential risk factors for dyskinesia: a meta-analysis of levodopa-controlled trials. Eur J Neurol,2014,21: 433-440.
[8]. 盐酸普拉克索片说明书. 2020年版
[9]. Fox SH, Katzenschlager R, Lim SY, et al. International Parkinson and movement disorder society evidence-based medicine review: Update on treatments for the motor symptoms of Parkinson's disease. Mov Disord. 2018 Aug;33(8):1248-1266.
[10]. Ferreira JJ, Katzenschlager R, Bloem BR, et al. Summary of the recommendations of the EFNS/MDS-ES review on therapeutic management of Parkinson's disease. Eur J Neurol. 2013 Jan; 20(1): 5-15.
[11]. 刘玉丽. 盐酸普拉克索缓释片的临床应用进展. 国际药学研究杂志, 2014, 41: 98-101.
[12]. 王鲁宁, 邹永明,刘丽欣. 普拉克索:帕金森病治疗的新选择. 中国药物应用与监测, 2013, (1):1-4.
[13]. Jenner P, Könen-Bergmann M, Schepers C, et al. Pharmacokinetics of a once-daily extended-release formulation of pramipexole in healthy male volunteers: three studies. Clinical therapeutics.2009;31(11):2698-2711.
[14]. Rascol O, Barone P, Hauser RA, et al. Efficacy, safety, and tolerability of overnight switching from immediate- to once daily extended-release pramipexole in early Parkinson's disease. Mov Disord. 2010 Oct 30;25(14):2326-32.
[15]. Parkinson Study Group. Pramipexole vs levodopa as initial treatment for Parkinson disease: A randomized controlled trial. Parkinson Study Group. JAMA. 2000, 284: 1931-1938.
[16]. Parkinson Study Group CALM Cohort Investigators. Long-term effect of initiating pramipexole vs levodopa in early Parkinson disease. Arch Neurol,2009,66:563-570.
[17]. Stowe R, Ives N, Clarke CE, et al. Evaluation of the efficacy and safety of adjuvant treatment to levodopa therapy in Parkinson s disease patients with motor complications. Cochrane Database Syst Rev. 2010;(7):CD007166.
[18]. Schapira AH, Barone P, Hauser RA, et al. Extended-release pramipexole in advanced Parkinson disease: a randomized controlled trial. Neurology. 2011 Aug 23;77(8):767-74.
[19]. Mizuno Y, Yamamoto M, Kuno S, et al. Efficacy and safety of extended- versus immediate-release pramipexole in Japanese patients with advanced and L-dopa-undertreated Parkinson disease: a double-blind, randomized trial. Clin Neuropharmacol. 2012;35(4):174-181.
[20]. Hauser RA, Schapira AH, Rascol O, et al. Randomized, double-blind, multicenter evaluation of pramipexole extended release once daily in early Parkinson's disease. Mov Disord. 2010;25(15):2542-2549.
[21]. Wang Y, Sun S, Zhu S, et al. The efficacy and safety of pramipexole ER versus IR in Chinese patients with Parkinson's disease: a randomized, double-blind, double-dummy, parallel-group study. Translational Neurodegeneration. 2014, 3:11.
[22]. Shen Z, Kong D. Meta-analysis of the adverse events associated with extended-release versus standard immediate-release pramipexole in Parkinson disease. Medicine (Baltimore). 2018 Aug;97(34):e11316.
[23]. Rizos A, Sauerbier A, Antonini A, et al. A European multicentre survey of impulse control behaviours in Parkinson's disease patients treated with short- and long-acting dopamine agonists. Eur J Neurol. 2016 Aug;23(8):1255-61.
[24]. Pellicano C, Benincasa D, Fanciulli A, et al. The impact of extended release dopamine agonists on prescribing patterns for therapy of early Parkinson's disease: an observational study. Eur J Med Res. 2013 Dec 21;18:60.
[25]. Schapira AH, Barone P, Hauser RA, et al. Patient-reported convenience of once-daily versus three-times-daily dosing during long-term studies of pramipexole in early and advanced Parkinson's disease. Eur J Neurol. 2013; 20(1): 50-6.
[26]. Chan KA, Hsieh YC, Hsieh SF, et al. Changes in Pramipexole Utilization after Introduction of the Extended-Release Formulation: A Nationwide Study in Taiwan. Drugs Real World Outcomes. 2021;8(1):63-71.
